Reaksi Redoks
Reaksi kimia dapat digolongkan menjadi berbagai macam reaksi. Salah
satu diantaranya adalah reaksi yang berkaitan dengan perubahan bilangan
oksidasi dari atom-atom sebelum dan sesudah reaksi. Dari tinjauan
bilangan oksidasi reaksi dapat dibedakan menjadi 2 jenis reaksi yaitu :
- Golongan reaksi dimana atom-atom yang terlibat tidak mengalami perubahan bilangan oksidasi sebelum dan sesudah reaksi. Reaksi dimana atom-atom yang terlibat tidak mengalami perubahan bilangan oksidasi disebut reaksi bukan reduksi-oksidasi yang lazim disebut reaksi bukan redoks.
- Golongan reaksi dimana diantara atom-atom yang terlibat ada yang mengalami perubahan bilangan oksidasi. Sebelum dan sesudah reaksi bilangan oksidasi atom-atom yang terlibat tidak sama (berubah). Reaksi ini disebut reaksi reduksi-oksidasi (reaksi redoks).
Redoks ( reduksi-oksidasi). Reduksi adalah penerimaan elektron atau
penurunan bilangan oksidasi, sedangkan oksidasi adalah pelepasan
elektron atau peningkatan bilangan oksidasi
CONTOH : REAKSI REDUKSI
CONTOH : REAKSI OKSIDASI
Konsep-konsep dasar Redoks- Oksidasi adalah peristiwa pelepasan elektron atau penambahan (kenaikan) bilangan oksidasi
- Reduksi adalah peristiwa penangkapan elektron atau pengurangan (penurunan) bilangan oksidasi
- Reduktor (pereduksi) adalah zat yang mengalami oksidasi atau zat yang melepaskan elektron, atau zat yang bilangan oksidasinya naik
- Oksidator adalah zat yang mengalami reduksi atau zat yang menangkap elektron atau zat yang bilangan oksidasinya turun
- Redoks adalah reaksi yang terdiri dari peristiwa reduksi dan oksidasi atau reaksi perubahan bilangan oksidasi
- Reaksi disproporsionasi (autoredoks) adalah reaksi redoks dimana hanya satu jenis atom yang mengalami reduksi dan oksidasi atau reaksi redoks dimana hanya satu jenis atom yang bilangan oksidasinya berubah
- Mol elektron adalah selisih bilangan oksidasi.
Untuk
menyetarakan persamaan reaks redoks, diperlukan cara-cara khusus. Yaitu metode bilangan oksidasi dan metode setengah
reaksi.
1.Metode Bilangan Oksidasi
Langkah-langkah penyetaraan reaksi :
- Menentukan unsur yang mengalami oksidasi dan reduksi berdasarkan perubahan bilangan oksidasi tiap unsur
- Menyetarakan jumlah unsur yang mengalami redoks dengan menambahkan koefisien yang sesuai
- Menentukan besarnya kenaikan atau penurunan bilangan oksidasi dari unsur-unsur yang mengalami perubahan bilangan oksidasi
- Meneyetarakan perubahan bilangan oksidasi tersebut dengan memberikan koefisien yang sesuai
- Menyetarakan jumlah atom H dan O serta unsur-unsur yang lain
Langkah-langkah penyetaraan reaksi:
- Menuliskan zat-zat yang mengalami reaksi redoks saja
- Memisahkan reaksi menjadi 2, setengah reaksi reduksi dan setengah reaksi oksidasi
- Menyetarakan atom-atom yang mengalami redoks, kecuali atom hydrogen (H) dan oksigen (O)
- Menyetarakan atom oksigen (O) dengan menambahkan molekul H2O ke ruas yang kekurangan oksigen
- Menyetarakan atom Hidrogen (H) dengan menambahkan ion H+ ke ruas yang kekurangan atom H
- Menyetarakan muatan dengan menambahkan elektron ke ruas yang memiliki muatan lebih positif
- Menyamakan jumlah elektron pada kedua persamaan setengah reaksi reduksi dan oksidasi
- Menyatukan kedua persamaan setengah reaksi menjadi reaksi redoks yang utuh
- Mengembalikan ke bentuk reaksi awal.
Dalam reaksi redoks terjadi transfer elektron dari reduktor ke oksidator. Pengetahuan adanya transfer elektron memberikan manfaat dalam upaya mengembangkan sumber energi listrik alternatif sebab aliran listrik tiada lain adalah aliran elektron. Bidang ilmu yang mempelajari energi listrik dalam reaksi kimia disebut elektrokimia. Perangkat atau instrumen untuk membangun energi listrik dari reaksi kimia dinamakan sel elektrokimia.
Sel elektrokimia merupakan suatu sel atau tempat terjadinya aliran
elektron yang disebabkan oleh perubahan energi kimia menjadi energi
listrik atau sebaliknya. Sel ini dikelompokkan menjadi dua macam yaitu :
1. Sel Volta
2. Sel Elektrolisis
Sel Volta melibatkan perubahan energi kimia menjadi energi listrik sedangkan sel elektrolisis melibatkan perubahan energi listrik menjadi energi kimia. Bagaimanakah proses terjadinya perubahan energi tersebut?
Rangkaian sel elektrokimia pertama kali dipelajari oleh LUIGI GALVANI (1780) danALESSANDRO VOLTA (1800). Sehingga disebut sel Galvani atau sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia tersebut. Energi yang dihasilkan dari reaksi kimia sel Volta berupa energi listrik
Sel Volta terdiri atas elektroda (logam seng dan tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam (agar-agar yang mengandung KCl). Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui sebuah voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda (elektroda negatif), sedangkan elektroda tempat berlangsungnya reduksi disebut Katoda (elektroda positif)
1. Sel Volta
2. Sel Elektrolisis
Sel Volta melibatkan perubahan energi kimia menjadi energi listrik sedangkan sel elektrolisis melibatkan perubahan energi listrik menjadi energi kimia. Bagaimanakah proses terjadinya perubahan energi tersebut?
SEL VOLTA
Sel Volta (sel galvani) memanfaatkan reaksi spontan (∆G < 0)
untuk membangkitkan energi listrik, selisih energi reaktan (tinggi)
dengan produk (rendah) diubah menjadi energi listrik. Sistem reaksi
melakukan kerja terhadap lingkungan
Sel Elektrolisa memanfaatkan energi listrik untuk menjalankan
reaksi non spontan (∆G > 0) lingkungan melakukan kerja terhadap
sistem
Kedua tipe sel menggunakan elektroda, yaitu zat yang menghantarkan
listrik antara sel dan lingkungan dan dicelupkan dalam elektrolit
(campuran ion) yang terlibat dalam reaksi atau yang membawa muatan.
KOMPONEN SEL VOLTARangkaian sel elektrokimia pertama kali dipelajari oleh LUIGI GALVANI (1780) danALESSANDRO VOLTA (1800). Sehingga disebut sel Galvani atau sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia tersebut. Energi yang dihasilkan dari reaksi kimia sel Volta berupa energi listrik
Sel Volta terdiri atas elektroda (logam seng dan tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam (agar-agar yang mengandung KCl). Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui sebuah voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda (elektroda negatif), sedangkan elektroda tempat berlangsungnya reduksi disebut Katoda (elektroda positif)
ELEKTRODA
Elektroda terbagi menjadi dua jenis yaitu anoda dan katoda
Setengah reaksi oksidasi terjadi di anoda. Elektron diberikan oleh
senyawa teroksidasi (zat pereduksi) dan meninggalkan sel melalui anoda
Setengah reaksi reduksi terjadi di katoda. Elektron diambil oleh
senyawa tereduksi (zat pengoksidasi) dan masuk sel melalui katoda.
Setengah sel oksidasi: anoda berupa batang logam Zn dicelupkan dalam ZnSO4
Setengah sel reduksi: katoda berupa batang logam Cu dicelupkan dalam CuSO4
Terbentuk muatan relatif pada kedua elektroda dimana anoda bermuatan negatif dan katoda bermuatan positif
Kedua sel juga dihubungkan oleh jembatan garam yaitu tabung
berbentuk U terbalik berisi pasta elektrolit yang tidak bereaksi dengan
sel redoks gunanya untuk menyeimbangkan muatan ion (kation dan anion)
Dimungkinkan menggunakan elektroda inaktif yang tidak ikut bereaksi dalam sel volta ini misalnya grafit dan platinum.
NOTASI SEL VOLTA
•Sel Volta dinotasikan dengan cara yang telah disepakati (untuk sel Zn/Cu2+)
Zn(s)|Zn2+(aq)║Cu2+(aq)|Cu(s)
Bagian anoda (setengah sel oksidasi) dituliskan disebelah kiri bagian katoda
Garis lurus menunjukkan batas fasa yaitu adanya fasa yang berbeda (aqueous vs solid) jika fasanya sama maka digunakan tanda koma
Untuk elektroda yang tidak bereaksi ditulis dalam notasi diujung kiri dan ujung kanan.
POTENSIAL ELEKTRODA DAN GGL SEL
Dalam sel elektrokimia, untuk mendorong elektron mengalir melalui rangkaian luar dan menggerakkan ion-ion di dalam larutan menuju elektrode diperlukan suatu usaha. Usaha atau kerja yang diperlukan ini dinamakan aya erak istrik, disingkat GGL.
a. Makna GGL Sel
Kerja yang diperlukan untuk menggerakkan muatan listrik (GGL) di dalam sel bergantung pada perbedaan potensial di antara kedua elektrode. Beda potensial ini disebabkan adanya perbedaan kereaktifan logam di antara kedua elektrode. Nilai GGL sel merupakan gabungan dari potensial anode (potensial oksidasi) dan potensial katode (potensial reduksi). Dalam bentuk persamaan ditulis sebagai berikut.
Kerja yang diperlukan untuk menggerakkan muatan listrik (GGL) di dalam sel bergantung pada perbedaan potensial di antara kedua elektrode. Beda potensial ini disebabkan adanya perbedaan kereaktifan logam di antara kedua elektrode. Nilai GGL sel merupakan gabungan dari potensial anode (potensial oksidasi) dan potensial katode (potensial reduksi). Dalam bentuk persamaan ditulis sebagai berikut.
Potensial reduksi adalah ukuran kemampuan suatu oksidator (zat pengoksidasi = zat tereduksi) untuk menangkap elektron dalam setengah reaksi reduksi. Potensial oksidasi kebalikan dari potensial reduksi dalam reaksi sel elektrokimia yang sama.
Tinjaulah setengah reaksi sel pada elektrode Zn dalam larutan ZnSO4 Reaksi setengah selnya sebagai berikut.
Jika –EZn adalah potensial elektrode untuk setengah reaksi oksidasi, +EZn adalah potensial untuk setengah sel reduksinya:
Potensial oksidasi: Zn (s) Zn2+ (aq) + 2e- EZn = –EZnV
Zn2+ (aq) + 2e- Zn (s) EZn= EZnV
Dengan demikian, nilai GGL sel sama dengan perbedaan potensial kedua elektrode. Oleh karena reaksi reduksi terjadi pada katode dan reaksi oksidasi terjadi pada anode maka nilai GGL sel dapat dinyatakan sebagai perbedaan potensial berikut.
Nilai potensial elektrode tidak bergantung pada jumlah zat yang terlibat dalam reaksi. Berapapun jumlah mol zat yang direaksikan, nilai potensial selnya tetap. Contoh:
b. Potensial Elektrode Standar (E )
Oleh karena potensial oksidasi merupakan kebalikan dari potensial reduksinya maka data potensial elektrode suatu logam tidak perlu diketahui dua-duanya, melainkan salah satu saja. Misalnya, data potensial reduksi atau data potensial oksidasi. Menurut perjanjian IUPAC, potensial elektrode yang dijadikan sebagai standar adalah potensial reduksi. Dengan demikian, semua data potensial elektrode standar dinyatakan dalam bentuk potensial reduksi standar.
Potensial reduksi standar adalah potensial reduksi yang diukur pada keadaan standar, yaitu konsentrasi larutan M (sistem larutan) atau tekanan atm (sel yang melibatkan gas) dan suhu o.
Untuk mengukur potensial reduksi standar tidak mungkin hanya setengah sel (sel tunggal) sebab tidak terjadi reaksi redoks. Oleh sebab itu, perlu dihubungkan dengan setengah sel oksidasi. Nilai GGL sel yang terukur dengan voltmeter merupakan selisih kedua potensial sel yang dihubungkan (bukan nilai mutlak). Berapakah nilai pasti dari potensial reduksi?
Oleh karena nilai GGL sel bukan nilai mutlak maka nilai potensial salah satu sel tidak diketahui secara pasti. Jika salah satu elektrode dibuat tetap dan elektrode yang lain diubah-ubah, potensial sel yang dihasilkan akan berbeda. Jadi, potensial sel suatu elektrode tidak akan diketahui secara pasti, yang dapat ditentukan hanya nilai relatif potensial sel suatu elektrode. Oleh karena itu, untuk menentukan potensial reduksi standar diperlukan potensial elektrode rujukan sebagai acuan. Dalam hal ini, IUPAC telah menetapkan elektrode standar sebagai rujukan adalah elektrode hidrogen, seperti ditunjukkan gambar di bawah ini :
Oleh karena potensial elektrode hidrogen pada keadaan standar ditetapkan sama dengan nol, potensial yang terukur oleh voltmeter dinyatakan sebagai potensial sel pasangannya.
BerdasarkanContoh 2.6, potensial elektrode yang lain untuberbagai reaksi setengah sel dapat diukur, hasilnya ditunjukkan pada Tabel 2.1.
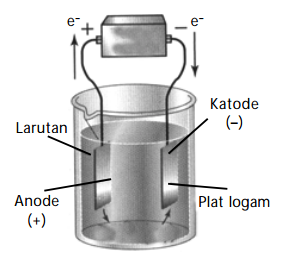
Sel Elektrolisis
Sel volta menghasilkan arus listrik searah ketika reaksi redoks di dalam sel terjadi secara spontan. Adapun sel elektrolisis merupakan kebalikan dari sel volta, yakni menerapkan arus listrik searah untuk mendorong agar terjadi reaksi elektrokimia di dalam sel.
1. Prinsip Elektrolisis
Elektrolisis artinya penguraian suatu zat akibat arus listrik. Zat yang terurai dapat berupa padatan, cairan, atau larutan. Arus listrik yang digunakan adalah arus searah (direct current = DC ).
Tempat berlangsungnya reaksi reduksi dan oksidasi dalam sel elektrolisis sama seperti pada sel volta, yaitu anode (reaksi oksidasi) dan katode (reaksi reduksi). Perbedaan sel elektrolisis dan sel volta terletak pada kutub elektrode. Pada sel volta, anode (–) dan katode (+), sedangkan pada sel elektrolisis sebaliknya, anode (+) dan katode (–).
Pada sel elektrolisis anode dihubungkan dengan kutub positif sumber energi listrik, sedangkan katode dihubungkan dengan kutub negatif. Oleh karena itu pada sel elektrolisis di anode akan terjadi reaksi oksidasi dan dikatode akan terjadi reaksi reduksi.
Nilai potensial elektrode tidak bergantung pada jumlah zat yang terlibat dalam reaksi. Berapapun jumlah mol zat yang direaksikan, nilai potensial selnya tetap. Contoh:
b. Potensial Elektrode Standar (E )
Oleh karena potensial oksidasi merupakan kebalikan dari potensial reduksinya maka data potensial elektrode suatu logam tidak perlu diketahui dua-duanya, melainkan salah satu saja. Misalnya, data potensial reduksi atau data potensial oksidasi. Menurut perjanjian IUPAC, potensial elektrode yang dijadikan sebagai standar adalah potensial reduksi. Dengan demikian, semua data potensial elektrode standar dinyatakan dalam bentuk potensial reduksi standar.
Potensial reduksi standar adalah potensial reduksi yang diukur pada keadaan standar, yaitu konsentrasi larutan M (sistem larutan) atau tekanan atm (sel yang melibatkan gas) dan suhu o.
Untuk mengukur potensial reduksi standar tidak mungkin hanya setengah sel (sel tunggal) sebab tidak terjadi reaksi redoks. Oleh sebab itu, perlu dihubungkan dengan setengah sel oksidasi. Nilai GGL sel yang terukur dengan voltmeter merupakan selisih kedua potensial sel yang dihubungkan (bukan nilai mutlak). Berapakah nilai pasti dari potensial reduksi?
Oleh karena nilai GGL sel bukan nilai mutlak maka nilai potensial salah satu sel tidak diketahui secara pasti. Jika salah satu elektrode dibuat tetap dan elektrode yang lain diubah-ubah, potensial sel yang dihasilkan akan berbeda. Jadi, potensial sel suatu elektrode tidak akan diketahui secara pasti, yang dapat ditentukan hanya nilai relatif potensial sel suatu elektrode. Oleh karena itu, untuk menentukan potensial reduksi standar diperlukan potensial elektrode rujukan sebagai acuan. Dalam hal ini, IUPAC telah menetapkan elektrode standar sebagai rujukan adalah elektrode hidrogen, seperti ditunjukkan gambar di bawah ini :
Oleh karena potensial elektrode hidrogen pada keadaan standar ditetapkan sama dengan nol, potensial yang terukur oleh voltmeter dinyatakan sebagai potensial sel pasangannya.
BerdasarkanContoh 2.6, potensial elektrode yang lain untuberbagai reaksi setengah sel dapat diukur, hasilnya ditunjukkan pada Tabel 2.1.
Sel Elektrolisis
Sel volta menghasilkan arus listrik searah ketika reaksi redoks di dalam sel terjadi secara spontan. Adapun sel elektrolisis merupakan kebalikan dari sel volta, yakni menerapkan arus listrik searah untuk mendorong agar terjadi reaksi elektrokimia di dalam sel.
1. Prinsip Elektrolisis
Elektrolisis artinya penguraian suatu zat akibat arus listrik. Zat yang terurai dapat berupa padatan, cairan, atau larutan. Arus listrik yang digunakan adalah arus searah (direct current = DC ).
Tempat berlangsungnya reaksi reduksi dan oksidasi dalam sel elektrolisis sama seperti pada sel volta, yaitu anode (reaksi oksidasi) dan katode (reaksi reduksi). Perbedaan sel elektrolisis dan sel volta terletak pada kutub elektrode. Pada sel volta, anode (–) dan katode (+), sedangkan pada sel elektrolisis sebaliknya, anode (+) dan katode (–).
Pada sel elektrolisis anode dihubungkan dengan kutub positif sumber energi listrik, sedangkan katode dihubungkan dengan kutub negatif. Oleh karena itu pada sel elektrolisis di anode akan terjadi reaksi oksidasi dan dikatode akan terjadi reaksi reduksi.
 | ||||
| sel elektrolisis |
a. Ion OH ¯ dioksidasi menjadi H2O dan O2. Reaksinya:
b. Ion sisa asam yang mengandung oksigen (misalnya NO3¯, SO42¯) tidak dioksidasi, yang dioksidasi air. Reaksinya:
c. Ion sisa asam yang lain dioksidasi menjadi molekul. Contoh:
Pada katoda terjadi reaksi reduksi, yaitu kation (ion positif) ditarik oleh katoda dan menerima tambahan elektron, sehingga bilangan oksidasinya berkurang.
a. Ion H+ direduksi menjadi H2. Reaksinya:
b. Ion logam alkali (IA) dan alkali tanah (IIA) tidak direduksi, yang direduksi air.
c. Ion logam lain (misalnya Al3+, Ni2+, Ag+dan lainnya) direduksi. Contoh:
Contoh Elektrolisis
Proses elektrolisis dalam industri misalnya:
a. Penyepuhan (melapisi logam dengan logam lebih mulia misal Ni, Cr, atau Au).
b. Pemurnian logam (misal Ag, Cu, Au).
c. Pembuatan senyawa (misal NaOH) atau gas (misal O2, H2, Cl2).
a. Penyepuhan (melapisi logam dengan logam lebih mulia misal Ni, Cr, atau Au).
b. Pemurnian logam (misal Ag, Cu, Au).
c. Pembuatan senyawa (misal NaOH) atau gas (misal O2, H2, Cl2).
Hukum Faraday
Hukum Faraday I
Jumlah massa zat yang dihasilkan pada katoda atau anoda berbanding lurus
dengan jumlah listrik yang digunakan selama elektrolisis.
Apabila arus listrik sebesar 1 Faraday ( 1 F ) dialirkan ke dalam sel maka akan dihasilkan :
- 1 ekivalen zat yang disebut massa ekivalen (e)
- 1 mol elektron ( e- )
Cara menghitung massa ekivalen (e) :
e = Ar Unsur / jumlah muatan ionnya
sebagai contoh jika 1 F dialirkan ke reaksi elektrolisis :
e = Ar Unsur / jumlah muatan ionnya
sebagai contoh jika 1 F dialirkan ke reaksi elektrolisis :
Cu2+ + 2e- → Cu
maka massa ekivalen ( e ) logam Cu (Ar Cu = 63,5) = e Cu = 63,5/2 = 31,75
jika arus listrik diperbesar menjadi 2 kalinya massa Cu yang diendapkan juga dikali 2.
Dalam penulisan perbandingan mol suatu reaksi yang dijadikan patokan adalah mol dari elekrton.....
jika mol elektron = 1 mol maka :
Cu2+ + 2e- → Cu
1/2 mol 1 mol 1/2 mol
maka massa ekivalen ( e ) logam Cu (Ar Cu = 63,5) = e Cu = 63,5/2 = 31,75
jika arus listrik diperbesar menjadi 2 kalinya massa Cu yang diendapkan juga dikali 2.
Dalam penulisan perbandingan mol suatu reaksi yang dijadikan patokan adalah mol dari elekrton.....
1 F = 1 mol e
(penting banget.... :) )
jika mol elektron = 1 mol maka :
Cu2+ + 2e- → Cu
1/2 mol 1 mol 1/2 mol
Hubungan Muatan Listrik dengan Arus Listrik
Keterangan :
C = muatan listrik ( Coloumb )
I = arus listrik ( Ampere )
t = waktu ( sekon )
sedangkan hubungan antara Faraday dan muatan listrik ( C ) :
maka rumus Faraday :
dan massa logam yang diendapkan :
Hubungan Hukum Faraday dengan Elektrolisis
Jika arus listrik 1 A dialirkan ke dalam 100 ml larutan perak nitrat AgNO3 melalui elektroda Pt selama 1930 detik maka hitunglah Ph nya!
elektrolisis larutan AgNO3 dengan elektroda Pt
Keterangan :
C = muatan listrik ( Coloumb )
I = arus listrik ( Ampere )
t = waktu ( sekon )
sedangkan hubungan antara Faraday dan muatan listrik ( C ) :
maka rumus Faraday :
dan massa logam yang diendapkan :
Hubungan Hukum Faraday dengan Elektrolisis
Jika arus listrik 1 A dialirkan ke dalam 100 ml larutan perak nitrat AgNO3 melalui elektroda Pt selama 1930 detik maka hitunglah Ph nya!
elektrolisis larutan AgNO3 dengan elektroda Pt
Katoda (+) : Ag+(aq) + e- → Ag(s)
Anoda (-) : 2H2O(aq) → 4H+(aq) + O2(g) + 4e-
reaksi pada anoda terlihat dihasilkan ion H+ maka larutan tersebut bersifat asam. mula2 kita cari dahulu muatan yang lewat dalam larutan :
karena F = mol elektron maka mol e- = 0,02 mol
2H2O(aq) → 4H+(aq) + O2(g) + 4e-
0,02 mol 0,02 mol
konsentrasi H dalam larutan :
Hukum Faraday II
Apabila 2 sel atau lebih dialiri arus listrik dalam jumlah yang sama (disusun seri) maka perbandingan massa zat-zat yang dihasilkan sebanding dengan massa ekivalen (e) zat-zat tersebut.
Apabila 2 sel atau lebih dialiri arus listrik dalam jumlah yang sama (disusun seri) maka perbandingan massa zat-zat yang dihasilkan sebanding dengan massa ekivalen (e) zat-zat tersebut.

Keterangan :
m = massa zat dalam gram
e = massa ekivalen zat
Ar = massa molekul relatif
n = muatan ion positif zat/kation
Contoh :
Jika arus listrik dialirkan melalui larutan AgNO3 dan Ni (NO3)2 yang disusun seri maka akan terjadi endapan perak sebanyak 27 gram. Hitung massa endapan nikel yang terjadi! (Ar Ag = 108 dan Ar Ni = 59)
n Ag = 1 dan n Ni = 2
m Ag : m Ni = Ar Ag/n Ag : Ar Ni/n Ni
27 : m Ni = 108/1 : 59/2
m Ni = 7,375 gram
m = massa zat dalam gram
e = massa ekivalen zat
Ar = massa molekul relatif
n = muatan ion positif zat/kation
Contoh :
Jika arus listrik dialirkan melalui larutan AgNO3 dan Ni (NO3)2 yang disusun seri maka akan terjadi endapan perak sebanyak 27 gram. Hitung massa endapan nikel yang terjadi! (Ar Ag = 108 dan Ar Ni = 59)
n Ag = 1 dan n Ni = 2
m Ag : m Ni = Ar Ag/n Ag : Ar Ni/n Ni
27 : m Ni = 108/1 : 59/2
m Ni = 7,375 gram




































0 komentar:
Posting Komentar